A diretriz adotada pela agência reguladora brasileira, ANVISA (Agência Nacional de Vigilância Sanitária), para registro de medicamentos biológicos, incluindo os biossimilares, é a RDC 55/2010(1). Nessa resolução, a via de desenvolvimento relacionada aos biossimilares é a via de desenvolvimento por comparabilidade. Além dessa diretriz normativa, a ANVISA também lançou em 2011 um guia que orienta sobre o exercício de comparabilidade(2) e outro que trata da elaboração de relatórios de estudos clínicos(3).
Somados a essa diretriz e guias, outras normas devem ser seguidas para produção, uso e comercialização desses medicamentos, formando o arcabouço regulatório para medicamentos biológicos, ilustrado na Figura 1.
Adotando essas normas, a ANVISA consegue avaliar alguns aspectos relevantes para garantir que o medicamento biossimilar tenha a qualidade desejada e com isso, tenha o mesmo perfil de segurança e eficácia que o medicamento comparador (inovador). De uma forma geral, os principais pontos avaliados para um biossimilar, além daqueles já observados para outros medicamentos biológicos, são a prova de biossimilaridade em termos de qualidade, segurança, eficácia e imunogenicidade comparativamente ao medicamento comparador.
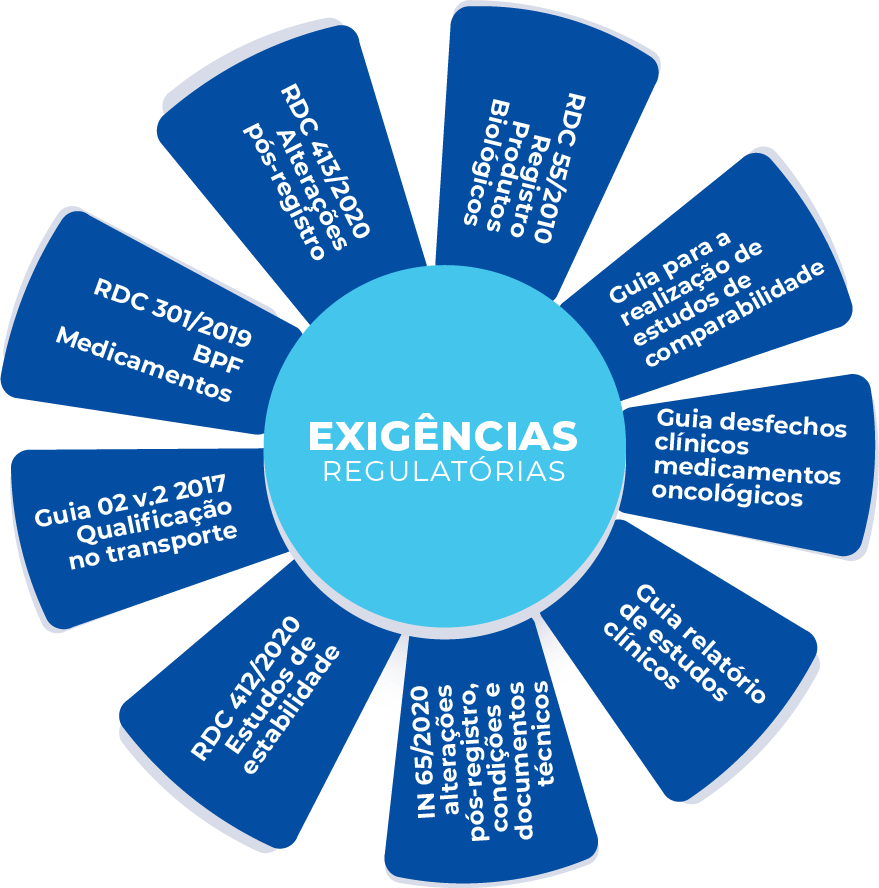
Figura 1 – Principais legislações e guias do arcabouço regulatório para o registro de medicamentos biológicos e biossimilares no Brasil. Figura elaborada por GetBio Consulting, com base na Biblioteca de Medicamentos ANVISA (4).
1. Brasil. Ministério da Saúde. Agência de Vigilância Sanitária. Resolução da Diretoria Colegiada – RDC n° 55, de 16 de dezembro de 2010. Dispõe sobre o registro de produtos biológicos novos e produtos biológicos e dá outras providências [Internet]. Brasília (DF): Diário Oficial da União; 2010; n°. 241, dezembro 17. Disponível em: http://portal.anvisa.gov.br/documents/10181/2718376/RDC_55_2010_COMPpdf/bb86b1c8-d410-4a51-a9df-a61e165b9618
2. ANVISA. Guia para realização do exercício de comparabilidade para registro de produtos biológicos. [Online] 2011
3. Guia para Elaboração de Relatórios de Estudos Clínicos para fins de Registro e/ou Alterações Pós-registro de Produtos Biológicos. [Online] 2011.
4. ANVISA. Biblioteca de Medicamentos . [Online] 13 de 12 de 2021. https://www.gov.br/anvisa/pt-br/assuntos/regulamentacao/legislacao/bibliotecas-tematicas/arquivos/medicamentos
E receba conteúdos e informações sobre medicamentos Biológicos
Biológicos Brasil ® 2024 – Todos os direitos reservados.